
O propósito do presente artigo é discutir vários aspectos teóricos e práticos da atividade clínica de idosos com risco de desenvolvimento de demência, especialmente a doença de Alzheimer (DA).
O discernimento entre a cognição normal no envelhecimento e a identificação de alterações cognitivas iniciais de uma demência em curso, particularmente a doença de Alzheimer, nem sempre é tarefa fácil. Essa dificuldade perdura há várias décadas e tem gerado definições específicas na tentativa de determinar “quanto” há de normal nas alterações cognitivas do idoso e “quanto” as perdas já representam o início de uma deterioração progressiva. “Esquecimento benigno da senescência”;1 “comprometimento de memória associado à idade”;2 “declínio cognitivo associado à idade”;3 “comprometimento cognitivo, mas não demência”;4 “comprometimento cognitivo leve”;5 e mais recentemente “transtorno neurocognitivo leve/menor”6 – essas constituem as principais tentativas de definição da transição entre o “normal” e o “patológico” no que tange à cognição no idoso. Nos últimos anos, a expressão mais utilizada tem sido “comprometimento cognitivo leve” (CCL), redefinido posteriormente,6 e que adotaremos neste artigo. Essa condição, o CCL, refere-se a um estado cognitivo de pessoas sem demência que relatam alterações de memória de fatos da vida cotidiana, confirmados por pessoa próxima, e objetivamente mensuráveis por testes específicos, sem impacto importante nas atividades instrumentais da vida diária ou com algumas repercussões leves nesse domínio.7,8
...a importância do CCL diz respeito à necessidade de saber se as alterações de memória expressam um perfil cognitivo próprio da senescência (envelhecimento normal) ou se sugerem uma condição prodrômica de demência, inclusive, doença de Alzheimer.
A resposta a essa pergunta é complexa, como se verá adiante.
Convém considerar que o cenário que envolve o CCL deve preocupar os médicos que atendem pessoas idosas porque de 5% a 15%, em média, das que apresentam esse quadro evoluem para demência, inclusive DA, condição até o momento inexorável.7 Essa taxa aumenta à medida que a duração da condição se estende ao longo dos anos. Assim, o médico deve estar ciente de que o CCL não representa uma condição que possa ser ignorada. Embora a maioria dos indivíduos com CCL se mantenha ativa em termos cognitivos e funcionais, a possibilidade de progressão para demência, particularmente para doença de Alzheimer, representa um risco considerável.8
Se, por um lado, o CCL não significa, per se, uma condição de demência incipiente, por outro, talvez antecipe a noção de que as alterações de memória podem, sim, representar uma condição prodrômica de uma doença neurodegenerativa em curso, como a de Alzheimer.9
Em essência, a importância do CCL diz respeito à necessidade de saber se as alterações de memória expressam um perfil cognitivo próprio da senescência (envelhecimento normal) ou se sugerem uma condição prodrômica de demência, inclusive, doença de Alzheimer. Obviamente a constatação precoce de um processo neurodegenerativo permitiria intervenções mais apropriadas, também de forma precoce. Antes de qualquer proposta de intervenção, porém, é preciso discutir o significado do declínio cognitivo.
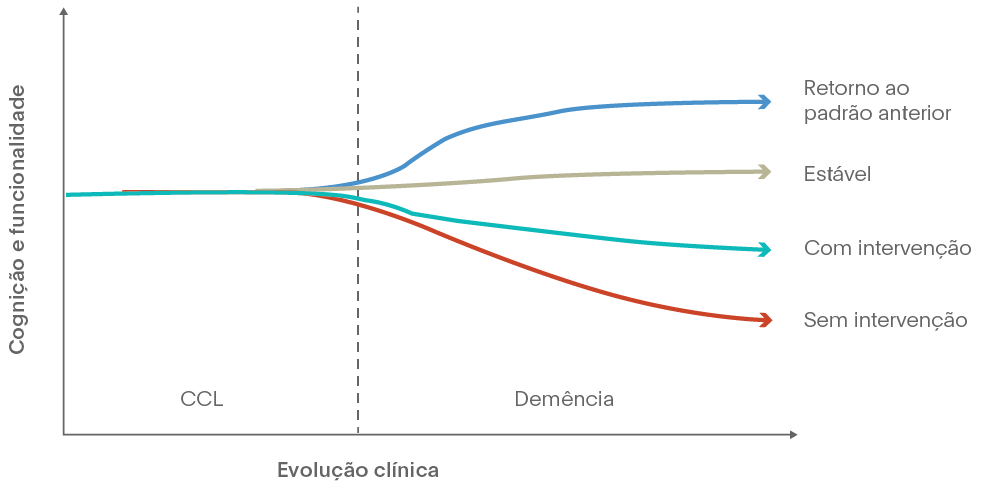
A maioria dos indivíduos que têm CCL não progride para demência ao longo da vida.10 Nesses indivíduos, o declínio de memória ou de outras funções cognitivas representa uma condição comum na senescência e não causa impacto desfavorável nas atividades instrumentais cotidianas. Trata-se, portanto, de um CCL que não progride para demência. Dessa forma, do ponto de vista clínico, as alterações de memória ou de outras funções cognitivas, como linguagem, orientação, reconhecimento e raciocínio, podem ser consideradas não representativas de um processo demencial em curso quando, ao longo do tempo, o indivíduo mantém o mesmo perfil cognitivo e o mesmo padrão de funcionalidade.
No entanto, todo paciente que apresenta, no momento da avaliação, um quadro de demência bem estabelecido passou antes por estágios iniciais, inclusive prodrômicos como o CCL.9,11 Em outras palavras, na condição de demência, como na DA, as alterações cognitivas causam impacto significativo na funcionalidade, levando progressivamente à perda da autonomia. Alterações neuropsiquiátricas como agitação, apatia, depressão e distúrbios do sono, dentre outras, são fenômenos muito frequentes na demência avançada.12
O quadro 1 mostra a evolução clínica das pessoas com CCL.
Evolução clínica do comprometimento cognitivo leve (CCL)
Elaborado pelo autor.
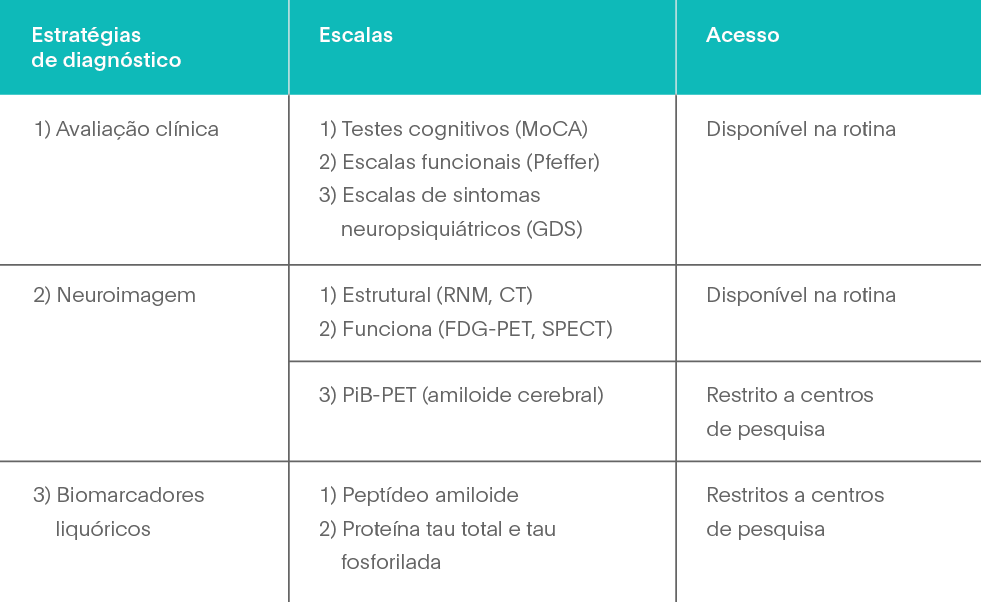
O diagnóstico de CCL é um procedimento complexo e depende de vários fatores. As alterações cognitivas, particularmente as de memória, são em geral muito leves e exigem investigação aprofundada. Do ponto de vista prático, o clínico pode utilizar vários testes que auxiliam em caso de suspeita de ocorrência desse quadro. Um screening inicial pode basear-se na aplicação de:
Com base nessa avaliação inicial, o encaminhamento para avaliação neuropsicológica abrangente se faz pertinente com a finalidade de se identificarem ou confirmarem eventuais alterações clinicamente significativas em domínios cognitivos distintos. A avaliação dos sintomas neuropsiquiátricos também deve fazer parte da investigação clínica, uma vez que os indivíduos com CCL podem apresentar depressão, agitação, ansiedade, apatia e distúrbios do sono, entre outros fenômenos psicopatológicos. Esse quadro, denominado de comprometimento comportamental leve, ou MBI, de mild behavioral impairment,14 aumenta, quando presente, o risco de progressão, principalmente para demência frontotemporal e doença de Alzheimer. O comprometimento comportamental leve também pode preceder alterações cognitivas no desenvolvimento de demência.
Convém destacar que a depressão é uma doença que causa declínio do processamento atencional e de memória episódica de fatos recentes. Assim, os pacientes com suspeita de demência inicial devem ser avaliados quanto à presença de depressão. A escala de depressão geriátrica, de 15 itens (GDS - geriatric depression scale),15 tem sido recomendada na aferição do nível de gravidade do quadro e incluída na avaliação.
Um estudo de neuroimagem, de preferência por ressonância magnética cerebral, para verificação das regiões mesiais do lobo temporal, especialmente dos hipocampos e lobos parietais, forneceria suporte relevante ao diagnóstico. Atrofia bilateral do hipocampo desproporcional às demais áreas cerebrais tende a reforçar o diagnóstico de CCL e pode sugerir suspeita de doença de Alzheimer inicial. O exame por meio de FDG-PET também pode expor hipometabolismo de regiões temporoparietais e, quando presente, sugere que o declínio de memória pode ser clinicamente relevante. Nos últimos anos têm surgido estudos de neuroimagem funcional com PiB-PET (marcador de amiloide cerebral de às demais áreas cerebrais tende a reforçar o diagnóstico de CCL e pode sugerir suspeita de doença de Alzheimer inicial. O exame por meio de FDG-PET também pode expor hipometabolismo de regiões temporoparietais e, quando presente, sugere que o declínio de memória pode ser clinicamente relevante. Nos últimos anos têm surgido estudos de neuroimagem funcional com PiB-PET (marcador de amiloide cerebral de Pittsburgh), o que pode antecipar a atrofia estrutural em pacientes com doença de Alzheimer. Entretanto, em nosso meio, a aplicação dessa técnica ainda se restringe a alguns centros acadêmicos ou de pesquisa.
Cabe destacar, por exemplo, que a investigação longitudinal, algum tempo (seis meses ou um ano) após a primeira avaliação, auxilia muito o clínico na tarefa de definir se o CCL se mantém estável ou se evolui para perdas progressivas. Os biomarcadores liquóricos representam um recurso crucial na definição do diagnóstico de indivíduos com CCL que, eventualmente, já têm doença de Alzheimer incipiente.9,11 Assim, o diagnóstico provável de DA pode ser feito no indivíduo com CCL que apresente o conjunto dos seguintes elementos:
O quadro 2 resume as estratégias de diagnóstico, a denominação de algumas escalas úteis à prática clínica e o acesso atual a esses recursos.Cabe ainda enfatizar que as pessoas com níveis elevados de escolaridade constroem maior nível de “reserva cognitiva”. Na avaliação, é pertinente ao clínico verificar o perfil da intelectualidade do paciente porque o padrão de sua reserva cognitiva pode protegê-lo de um declínio precoce.16 Em outras palavras, o paciente pode apresentar doença de Alzheimer sem que esta seja diagnosticada porque a expressão clínica – cognitiva e funcional – do quadro, ainda preservada, tende a “acobertar” um processo neurodegenerativo em curso.
Estratégias de diagnóstico, escalas utilizadas e acesso atualmente disponível
Elaborado pelo autor.
No que tange à intervenção clínica, no caso dos indivíduos sem CCL a conduta mais apropriada seria o controle dos fatores de risco cerebrovascular que, embora levem com mais frequência à instalação de demência vascular, também podem contribuir para a deflagração de um processo neurodegenerativo em curso, porém ainda pré-clínico. No caso daqueles que já têm CCL, o controle dos fatores de risco auxilia, pelo menos, no adiamento da curva de progressão para um quadro demencial definitivo. Essa intervenção preventiva implica o controle rigoroso desses fatores de risco, como hipertensão arterial, diabetes mellitus, distúrbios do metabolismo lipídico, síndrome metabólica e obesidade. Ademais, um estilo de vida saudável, que promova a prevenção do tabagismo e do uso abusivo de álcool ou de outras substâncias psicoativas, bem como a prática regular de exercícios físicos, preferencialmente aeróbios e de estimulação cognitiva, além de uma dieta saudável, é fundamental nesse cenário.11,17
Outra intervenção adjuvante na proteção do indivíduo em risco de desenvolver doença de Alzheimer é o uso de medical food – nutrientes cerebrais que melhoram a sobrevida da membrana neuronal, das sinapses e da atividade metabólica do neurônio e aumentam a resistência ao estresse oxidativo.18 Finalmente, no caso dos pacientes que já apresentam diagnóstico de doença de Alzheimer mesmo em fase inicial, os anticolinesterásicos (donepezil, galantamina e rivastigmina) representam a opção farmacológica recomendada. Com a progressão da doença, deve-se adicionar memantina (antiglutamatérgico) e outros psicofármacos quando necessário.19 Recomenda-se que a prescrição de psicofármacos deva sempre ser acompanhada de intervenção não farmacológica, como estimulação cognitiva e exercício físico.11